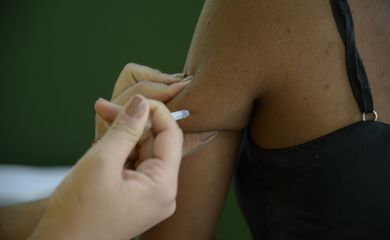
Brasil duplica capacidad de producción de vacunas para fiebre amarilla

El Instituto de Tecnología Inmunobiológica de la Fundación Oswaldo Cruz (Bio-Manguinhos/Fiocruz) ha incrementado su capacidad de producción de la vacuna contra la fiebre amarilla de 60 millones a aproximadamente 120 millones de frascos por año.

La autorización para esta nueva capacidad de producción fue otorgada este mes por la Agencia Nacional de Vigilancia Sanitaria (Anvisa), y se logró gracias a la eliminación de antibióticos de la fórmula de la vacuna, así como a la optimización del proceso de producción del Ingrediente Farmacéutico Activo (IFA).
Rosane Cuber, subdirectora de Calidad de Bio-Manguinhos, informó a Agência Brasil esta semana que la institución no solo suministra la vacuna a Brasil, sino que también la exporta a más de 70 países a través de agencias de las Naciones Unidas (ONU).
Cuber explicó que la calidad de la vacuna vírica se evalúa mediante la concentración de virus en su ingrediente. El desafío para los investigadores fue lograr una mayor cantidad de virus con la misma cantidad de huevos. "Lo conseguimos mediante un estudio en el que ajustamos los porcentajes de dilución de la vacuna. A través de varios estudios, modificando los parámetros de dilución y evaluando la concentración viral, alcanzamos un equilibrio óptimo. De esta manera, con la misma cantidad de huevos, pero ajustando el factor de dilución, logramos un rendimiento más alto, es decir, una mayor producción viral", explicó.
Antibióticos
Además del ajuste en la concentración viral, Bio-Manguinhos introdujo otra mejora al retirar los antibióticos de la vacuna contra la fiebre amarilla. Esta modificación se realizó a solicitud de la Organización Mundial de la Salud (OMS), que está emprendiendo esfuerzos significativos para reducir el uso generalizado de antibióticos en todo el mundo debido a los altos niveles de resistencia bacteriana.
El uso de antibióticos durante décadas tenía como objetivo prevenir la contaminación de los viales, pero según Fiocruz, las condiciones actuales son estériles, y el uso de antibióticos ya no resulta necesario. Fiocruz asegura que la eliminación de los antibióticos no afecta la seguridad y eficacia de la vacuna.
Rosane Cuber señaló que fue imprescindible llevar a cabo diversos estudios de estabilidad en tiempo real, ya que la vacuna, tras la modificación, requiere monitoreo durante su vida útil, que es de 36 meses. "Realizamos todos estos ajustes, controlamos el período y presentamos los cambios a Anvisa, que los aprobó en el mes de febrero", afirmó.
Como consecuencia, Bio-Manguinhos está listo para iniciar la producción de nuevos lotes del Ingrediente Farmacéutico Activo (API) con las dos mejoras implementadas: la eliminación de antibióticos en la formulación y el ajuste en la dilución, lo que permite obtener un mayor rendimiento de la vacuna con la misma cantidad de huevos. El director adjunto destacó que esto aumenta la capacidad de producción de API.
La producción de este nuevo ingrediente farmacéutico vírico comenzará en el presente año y se espera que esté disponible a partir de 2025. Cuber explicó que, aunque aún hay existencias de API producido con la formulación anterior, los próximos lotes se fabricarán con la nueva formulación. "El ministerio puede solicitar la vacuna, y estaremos en condiciones de suministrarla, sin restricciones. También podemos ofrecerla a las Naciones Unidas, por ejemplo. Ya no existen limitaciones en la producción de ingredientes farmacéuticos activos", afirmó.